

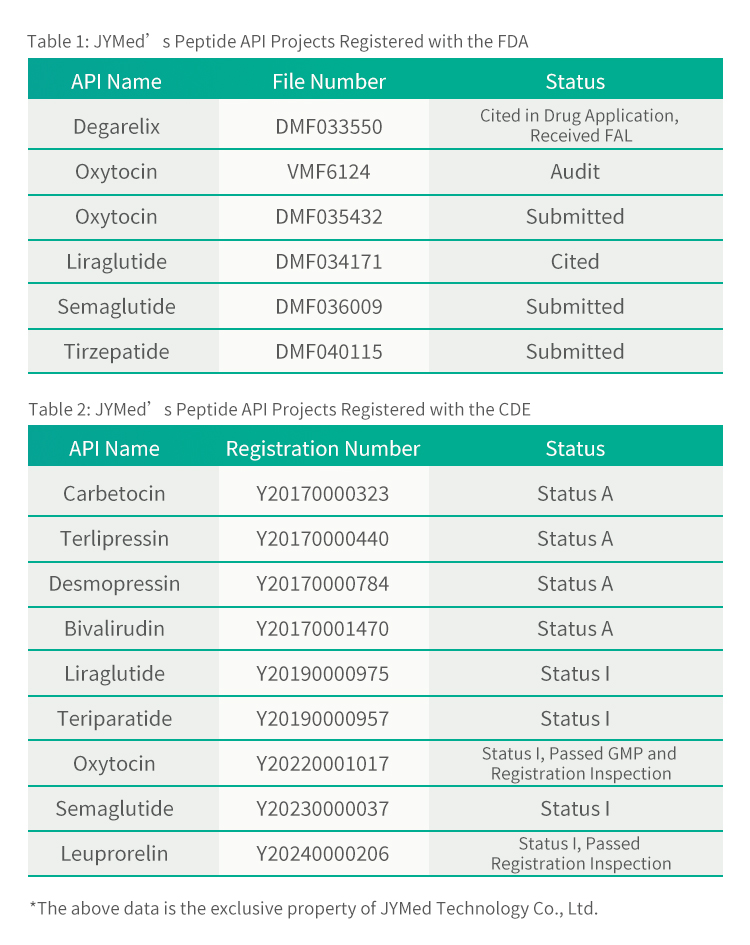
Компанія JYMed Technology Co., Ltd. рада повідомити, що її продукт, тирзепатид, успішно завершив реєстрацію в Головному файлі лікарського засобу (DMF) в Управлінні з контролю за харчовими продуктами та лікарськими засобами США (номер DMF: 040115) та отримав підтвердження FDA 2 серпня 2024 року.
Масове виробництво зі стабільною якістю
За словами вищого керівництва JYMed Technology, масове виробництво активного фармацевтичного інгредієнта (АФІ) тирзепатиду може досягати кілограмових обсягів. Виробничі партії стабільні та безперервні, з мінімальними коливаннями між партіями, що забезпечує стабільну якість.
Значний вплив на зниження рівня глюкози та ліпідів
Тирзепатид – перший у світі схвалений агоніст рецепторів GIP/GLP-1, який приймається один раз на тиждень. Як подвійний агоніст рецепторів, він може одночасно зв'язуватися та активувати як глюкозозалежний інсулінотропний поліпептидний (GIP) рецептор, так і рецептор GLP-1 в організмі людини. Окрім зниження рівня глюкози, він зменшує споживання їжі, масу тіла та вміст жиру, а також регулює утилізацію ліпідів. Окрім значного зниження рівня глюкози та ваги, аналіз підгруп із серії досліджень SURPASS показав, що Тирзепатид також покращує метаболічні показники, такі як артеріальний тиск, ліпіди крові, ІМТ та окружність талії.
Багатонаціональні схвалення та перспективні перспективи
Згідно з відповідною інформацією, препарат Mounjaro, що знижує рівень глюкози, вперше був схвалений Управлінням з контролю за якістю харчових продуктів і медикаментів США (FDA) у травні 2022 року для лікування дорослих з діабетом 2 типу. Згодом він отримав схвалення в ЄС, Японії та інших регіонах. У листопаді 2023 року FDA також схвалило препарат для зниження ваги під торговою маркою Zepbound. У травні 2024 року він успішно вийшов на китайський ринок. Завдяки широким перспективам застосування та переконливим підтверджуючим дослідницьким даним, Tirzepatide став одним з найвідоміших пептидних препаратів сьогодні. Його продажі досягли 5,163 мільярда доларів у 2023 році, а лише за перший квартал 2024 року продажі склали 2,324 мільярда доларів, що демонструє вражаючі темпи зростання.
Про JYMed

Компанія Shenzhen JYMed Technology Co., Ltd. (далі – JYMed) була заснована у 2009 році та спеціалізується на дослідженнях, розробці, виробництві та продажу пептидів і продуктів, пов'язаних з пептидами. Маючи один дослідницький центр і три основні виробничі бази, JYMed є одним з найбільших виробників хімічно синтезованих пептидних активних фармацевтичних інгредієнтів (API) у Китаї. Основна команда досліджень і розробок компанії має понад 20 років досвіду роботи в пептидній галузі та двічі успішно пройшла інспекції FDA. Комплексна та ефективна система індустріалізації пептидів JYMed пропонує клієнтам повний спектр послуг, включаючи розробку та виробництво терапевтичних пептидів, ветеринарних пептидів, антимікробних пептидів та косметичних пептидів, а також реєстраційну та регуляторну підтримку.
Основна діяльність
1. Внутрішня та міжнародна реєстрація пептидних активних фармацевтичних інгредієнтів (АФІ)
2. Ветеринарні та косметичні пептиди
3. Користувацькі пептиди та послуги CRO, CMO, OEM
4. Препарати ПДК (пептид-радіонуклід, пептид-мала молекула, пептид-білок, пептид-РНК)
Окрім тирзепатиду, JYMed подала до FDA та CDE реєстраційні документи на кілька інших активних фармацевтичних інгредієнтів (API), включаючи популярні наразі препарати класу GLP-1RA, такі як семаглутид та ліраглутид. Майбутні клієнти, які використовуватимуть продукти JYMed, зможуть безпосередньо посилатися на реєстраційний номер CDE або номер файлу DMF під час подання заявок на реєстрацію до FDA або CDE. Це значно скоротить час, необхідний для підготовки документів заявки, а також час оцінки та вартість розгляду продукту.
Зв'яжіться з нами


Шеньчжень JYMed Technology Co., Ltd.
Адреса:8-й та 9-й поверхи, корпус 1, Шеньчженьський біомедичний інноваційний промисловий центрПарк, № 14 Jinhui Road, Kengzi Sub District, Pingshan District, Shenzhen
Телефон:+86 755-26612112
Вебсайт: http://www.jymedtech.com/
Час публікації: 12 серпня 2024 р.







